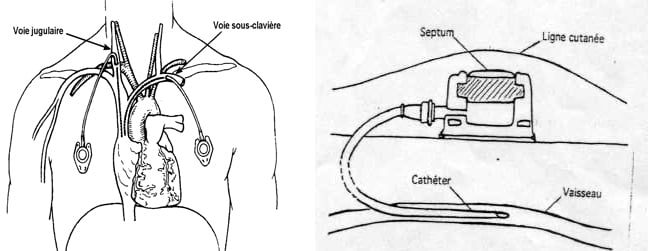
Introduit en France en 1983, le cathéter à chambre implantable est un dispositif médical de longue durée, entièrement implanté dans le tissu cellulo-graisseux sous-cutané du patient.
Ce dispositif permet de disposer d’une voie d’abord veineuse centrale sécurisée, utilisable en permanence, tout en permettant au patient de conserver une autonomie relativement compatible avec des activités physiques normales. L’injection se fait à travers la peau, l’aiguille traversant la membrane de la chambre implantable.
La composition du cathéter à chambre implantable
Ce dispositif est composé (Norme NFS 94-370) :
D’une chambre d’injection (boitier) le plus souvent en titane matériau amagnétique par excellence.
D’une membrane en silicone auto obturant dénommée septum, membrane destinée à recevoir un certain nombre de ponctions (1000/cm2) à condition d’utiliser’une aiguille spécifique, l’aiguille de Huber .
D’un cathéter en silicone ou polyuréthane, radio opaque, dont l’extrémité est placée à proximité de l’oreillette droite du cœur du patient. Suivant le fournisseur, le cathéter est le plus souvent à « bout ouvert » ou parfois à « bout fermé » comportant alors obligatoirement une valve type Groshong.

Le volume de la chambre d’injection est inférieur à 1 ml (0,2 à 0,6 ml), elle ne s’apparente donc pas à un véritable réservoir et ne nécessite pas d’effectuer un rinçage avec un volume important.
Il faut savoir que parfois la tendance est de poser pour raison de confort pour le patient adulte une chambre de type pédiatrique rendant cependant la ponction plus difficile pour le soignant. Le tableau suivant en résume les avantages et les inconvénients.
Caractéristiques | Adulte | Enfant | Conséquences |
| Diamètre de la base | 31,7mm | 24,8mm | Confort de pose Cicatrice plus petite |
| Diamètre du septum | 12,7mm | 9,0mm | Septum plus difficile à repérer Confort patient |
| Poids de la chambre (titane) | 15,4g | 7,7g | Confort de pose Confort patient |
| Volume mort du réservoir | 0,6ml | 0,2ml | Volume mort diminué |
| Hauteur de la chambre | 14,5mm | 9,4mm | Dispositif moins proéminent |
| Profondeur de pénétration de l’aiguille | 14,6mm | 7,9mm |
Abréviations couramment utilisées
- P.A.C : Port à Cath (marque commerciale Smiths).
- C.C.I : cathéter à chambre implantable.
- Site implantable.
- C.I.P : chambre implantable pour perfusion.
- D.V.I : dispositif veineux implantable (consensuelle depuis 2000).
- C.S.I : chambre à site implantable.
- S.A.V.I : site arterio-veineux implantable.
- D.I.V.L.D : dispositif intraveineux de longue durée.
Sites d’implantation
L’implantation intraveineuse du cathéter de la chambre implantable constitue l’indication la plus fréquente (95%). La mise en place du cathéter par ponction percutanée est la plus utilisée car réalisable sous anesthésie locale (éventuellement association de gaz « Kalinox® »). Les voies d’abord sont essentiellement la veine sous-clavière ou la veine jugulaire interne. (Recommandation n° 83 CTNIN)
La dénudation chirurgicale sous anesthésie générale est réservée en cas d’échec de l’abord percutané ou demandée par le patient. La localisation de la chambre reste le plus souvent thoracique mais parfois brachiale.
Accessoires spécifiques
Il est impératif d’utiliser pour ponctionner une chambre implantable, une aiguille à pointe de Huber, dispositif comportant un biseau tangentiel conçu pour limiter les dommages à type de carottage sur le septum (circulaire ministérielle 1996) . On distingue 2 types d’aiguilles , l’aiguille de type 1 et l’aiguille de type 2.
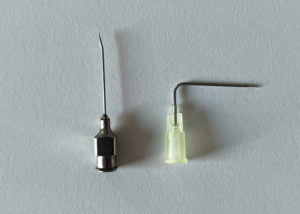
L’aiguille de Huber type 1
Il s’agit d’une aiguille droite ou courbe à biseau tangentiel (Huber) utilisée pour une injection ponctuelle ou un prélèvement sanguin.
Difficile à fixer, elle ne fait plus partie des dispositifs recommandés en ville et en milieu hospitalier. Depuis l’année 2000, l’HAS et la SF2H recommandent l’utilisation d’une aiguille sécurisée (aiguille de Huber type 2).
L’aiguille de Huber comporte un biseau tangentiel (dans l’axe de l’aiguille) minimisant l’effet « emporte-pièce » du matériau composant le septum.
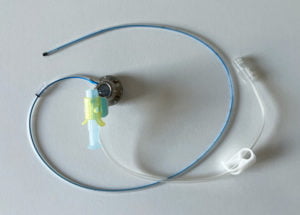
L’aiguille de Huber type 2 ou Gripper
L’aiguille de Huber type 2 comporte un prolongateur simple ou 2 voies avec connexion luer lock, un plateau en mousse reposant sur la peau du patient de manière à en faciliter la fixation sur la chambre.
| Gauge | mm | Longueur | Domaine conseillé |
| 23G | 0,6 | 20 | Pédiatrie |
| 22G | 0,7 | 25 | Chimiothérapie |
| 22G | 0,7* | 35 | |
| 20G | 0,9 | 20 | Prélèvement Perfusion |
| 20G | 0,9 | 35 | |
| 19G | 1,1 | 20 | Transfusion Alimentation parentérale |
La longueur de l’aiguille varie avec la corpulence du patient et la profondeur de la chambre implantable, le calibre doit être le plus fin possible (circulaire ministérielle 1996) tout en étant adapté à la viscosité du produit perfusé. Il existe actuellement une attitude consensuelle (HAS) pour privilégier la gauge 20G pour la plupart des perfusions. Si l’emploi d’une aiguille de 19G s’avère nécessaire, il es préférable de la retirer dès la fin de la perfusion (SF2H R35). La longueur de l’aiguille doit est adaptée à la profondeur de la chambre et à la corpulence du patient, une aiguille trop courte expose à un risque d’extravasation, une aiguille trop longue à un risque d’instabilité (SF2H R36 AF).
L’HAS recommande pour diminuer les AES d’utiliser un modèle de Gripper sécurisé. Cependant la LPPR 2016 rend obligatoire la fourniture d’une aiguille de Huber sécurisée par un PSAD.
Il existe sur le marché plusieurs modèles de Gripper sécurisés, je citerai pour exemples et de manière non exhaustive, Polyperf Safe Vygon, Surecan Safety BBraun, Safestep BD France, Gripper Plus Smiths Médical. Il me semble préférable de porter le choix sur un modèle dont l’ergonomie facilite la gestuelle du soignant notamment pour le retrait de l’aiguille de Huber en pression positive.
Lettres circulaires
En 1996, des circulaires ont eu pour objet un recadrage sur l’utilisation de certains dispositifs d’accès à la chambre implantable comme l’aiguille de Huber ou le format de la seringue.
Notamment le choix du volume de la seringue est primordial afin de limiter les pressions excessives dans la chambre implantable lors d’une injection, l’utilisation de seringues de volume inférieur à 10 ml est à proscrire (circulaire ministérielle 1996).
En effet à titre d’exemple :
La force exercée par le pouce sur le piston d’une seringue de taille moyenne (20 ml) est de l’ordre de 2 à 3 kPa/cm2, appliquée sur le piston d’une seringue de 2 ml, la pression transmise peut atteindre 11 à 17 kPa/cm2.
A titre de comparaison, le pied d’un éléphant de 4 tonnes exerce sur le sol une pression 10 fois moindre soit 1,1 kPa/cm2
La lettre circulaire DH/EM 1 96-6225 du 28 octobre 1996 relative à la sécurité des dispositifs médicaux fixe les conditions d’utilisation des aiguilles et des seringues :
« injection, perfusion, héparinisation et rinçage : utiliser une aiguille à biseau tangentiel de petit diamètre* (0,7 mm) ; (22G). L’utilisation d’aiguilles à biseau tangentiel de petit diamètre permet de préserver l’intégrité du septum et ainsi de garantir l’étanchéité du dispositif (…) ».
« Des aiguilles de plus grand diamètre (0,9 mm) ne doivent être utilisées que pour l’administration de nutrition parentérale et de dérivés sanguins ; » (20G).
« Par ailleurs, une pression trop brutale de l’aiguille sur le fond de la chambre peut émousser l’aiguille et ainsi altérer le septum lors du retrait de l’aiguille (..) après injection ou perfusion ou tentative, il ne faut jamais réutiliser les mêmes aiguilles et seringues ».
La lettre circulaire DH/EM 1 96-2517 du 24 mai 1996 relative à la sécurité des dispositifs médicaux précise de ne pas utiliser de seringue de petit diamètre pour désobstruer un cathéter implanté.
Il existe un risque de fracture et d’embolisation du cathéter…
Accès à la chambre implantable, recommandations HAS/SF2H :
Le patient doit être en DECUBITUS DORSAL strict pour toute intervention sur la chambre implantable, surtout pour la pose et l’ablation de l’aiguille de Huber, (patient allongé).
- La ligne veineuse doit permettre de rester en système clos, en minimisant les ouvertures (robinet ou connexion) et en regroupant au maximum les manipulations. Il est possible d’utiliser des dispositifs adaptés comme les valves bidirectionnelles.
- Les chambres non perfusées ne doivent jamais rester munies d’une aiguille (type Gripper), l’aiguille doit être retirée après toute perfusion unique et en fin de traitement (HAS). Cette recommandation pour être correctement suivie, doit faire l’objet d’un constat bénéfice/risque au niveau du patient (douleur, risque infectieux).
- En cas de perfusion continue, l’aiguille doit être changée tous les 7 jours, la ligne de perfusion toutes les 72 heures, voire quotidiennement en cas de nutrition parentérale, transfusion de sang ou dérivés. (Attitude consensuelle).
- Toutes les connexions doivent être manipulées avec une compresse imbibée d’antiseptique approprié (alcoolique). La Biseptine n’est pas recommandée sur les surfaces inertes..
- La perméabilité de la chambre implantable doit être vérifiée avant chaque injection ou perfusion par la vérification d’un reflux sanguin ou par une injection lente de sérum physiologique (seule possibilité pour les dispositifs ne permettant pas le reflux).
- Il est possible de faire des prélèvements sanguins sur une chambre implantable (SF2H R82 AF)
- Il est important de connaître la nature du matériel implanté (présence d’une valve type Groshong ? dispositif pédiatrique chez un adulte ?), le patient doit être en possession d’un carnet de surveillance rendu obligatoire par la circulaire ministérielle du 28 octobre 1996.
La chambre implantable est obligatoirement rincée avec du sérum physiologique après toute injection médicamenteuse ou nutrition parentérale, il est recommandé de retirer l’aiguille de Huber en exerçant obligatoirement une pression positive (retirer l’aiguille tout en injectant). La vidéo suivante vous en explique la gestuelle largement recommandée.
Il n’existe pas de consensus en matière de rinçure héparinée (sauf pédiatrie).
Une étude réalisée en 2000 recommande d’effectuer un rinçage de 10ml avec simplement du sérum physiologique, plus efficace, à condition de pratiquer un rinçage PULSE c’est-à-dire par pressions successives. Il est conseillé de pratiquer ce rinçage en trois ou quatre poussées. Cette méthode permet un bon nettoyage de la lumière interne du cathéter et de la chambre implantable par élimination du biofilm, l’objectif premier étant d’en éviter l’obstruction et la surinfection. Le rinçage pulsé avec une seringue de 10 ml de sérum physiologique est plus efficace car il permet 90% de décrochage de particules par rapport à 49% pour le rinçage continu en un seul bolus et 18% avec une perfusion garde veine sur 6 heures (J.Merckx 2010). Le rinçage en 10 poussées préconisé récemment n’a pas fait entièrement ses preuves.
SF2H R42 Le rinçage se fait avec une seringue de 10 ml de NaCL à 0,9% AF
SF2H R43 L’utilisation de seringues de rinçage pré-remplies de NaCL à 0,9% facilite le respect des bonnes pratiques AS
Carnet de suivi
La lettre circulaire DH/EM 1 96-6225 du 28 octobre 1996 relative à la sécurité des dispositifs médicaux, utilisation des chambres implantables, définit le contenu du carnet de surveillance :
« il doit comporter les éléments suivants : nom du patient, l’hôpital ayant implanté le dispositif, le modèle et le numéro de lot du dispositif, les précautions essentielles à respecter lors de l’utilisation du dispositif ainsi que les dates des perfusions et injections réalisées. Ce carnet doit être remis au patient. Celui-ci doit le présenter systématiquement aux équipes médicales intervenant sur la chambre, ce qui permet ainsi d’améliorer l’information entre les équipes médicales »(SF2H R90 Réglementaire)
Avantages du cathéter à chambre implantable
Confort psychologique du patient amélioré par la dissimulation totale du cathéter.
Facilite la reprise possible d’activités professionnelles et/ou sportives.
Soins locaux moins contraignants en l’absence de Gripper.
Système clos, moins de risques infectieux et d’embolie gazeuse, si retrait du Gripper lorsqu’il n’est pas utilisé.
Inconvénients du cathéter à chambre implantable
Intervention médicale plus lourde lors de la pose et de l’ablation.
Formation technique indispensable pour l’infirmier libéral.
Lors de certaines complications, le retrait de la chambre peut être vécu comme un drame par le patient.
Afin de détecter plus facilement les complications, il est très important pour le soignant de connaître les indicateurs de bon fonctionnement d’un cathéter ou d’une chambre implantable.
Indicateurs de bon fonctionnement de la chambre implantable (SF2H R49 AF).
- Présence d’un reflux veineux franc.
- Absence de douleurs à l’injection.
- Bon débit libre de perfusion (débit observé égal débit attendu) .
- Injection à la seringue facile.
L’absence de l’un de ces critères impose un examen clinique infirmier, voire médical (se référer à un arbre décisionnel).